Фебрильные судороги передаются ли по наследству
Обновлено: 18.04.2024
Что такое юношеская миоклоническая эпилепсия? Причины возникновения, диагностику и методы лечения разберем в статье доктора Аграновича Андрея Олеговича, невролога со стажем в 12 лет.
Над статьей доктора Аграновича Андрея Олеговича работали литературный редактор Вера Васина , научный редактор Татьяна Гаврилова и шеф-редактор Маргарита Тихонова
Определение болезни. Причины заболевания
Юношеской миоклонической эпилепсией (синдромом Янца) называют эпилептический синдром, который проявляется внезапными подёргиваниями в мышцах — миоклоническими приступами (от греч. "myos" — мышца, "klonos" — беспорядочное движение). Заболевание обычно развивается в подростковом возрасте.
Подёргивания в первую очередь возникают в мышцах верхнего плечевого пояса и рук. Сначала пациенты не обращают на них внимания, но со временем эпизоды возникают всё чаще и ухудшают качество жизни. Например, во время приступов из рук могут выпадать предметы. В дальнейшем появляются подёргивания ног, из-за которых человек может упасть.
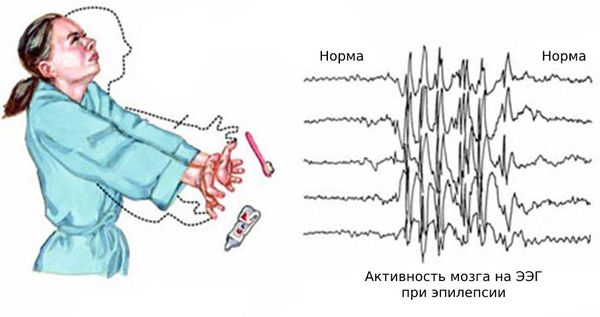
Нередко к этим эпизодам присоединяются генерализованные судорожные приступы — судороги возникают по всему телу и пациент теряет сознание. Также возникают абсансы — бессудорожные приступы с отключением сознания и амнезией на этот период. Как правило, частота генерализованных приступов невысокая: от одного за всю жизнь до раза в месяц. Подёргивания обычно случаются утром после пробуждения. Ярким провоцирующим фактором может стать недосыпание или вынужденное пробуждение. Также в трети случаев отмечается фотосенситивность — чувствительность к ритмическим вспышкам света.
Распространённость
Юношеская миоклоническая эпилепсия составляет 5–10 % среди всех эпилепсий и чуть больше четверти среди генетических генерализованных эпилепсий [5] . Заболевание проявляется в возрасте от 7 до 21 года, чаще в 11–15 лет, и более распространено среди женщин (61 %) [2] .
Причины заболевания
По классификации Международной противоэпилептической лиги за 2017 год, юношеская миоклоническая эпилепсия относится к генетическим болезням [1] . Заболевание имеет полигенное наследование, то есть контролируется двумя или более генами. Его развитие связано с локусами (участками ДНК): 6p11-12 (EJM1), 15q14 (EJM2), 6р21 (EJM3), 5q12-q14 (EJM4), 5q34-q35 (EJM5), 2q22-q23 (EJM6), 1p36 (EJM7), 3q26 (EJM8), 2q33-q36 (EJM9). Выделить ген, сильнее всего влияющий на развитие заболевание, пока не удалось [3] [4] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы юношеской миоклонической эпилепсии
Основным симптомом заболевания являются миоклонические вздрагивания (миоклонии) — патологические непроизвольные сокращения мышц или их групп [7] . Во время приступа пациенты испытывают ощущение, похожее на лёгкий удар током. В ответ на него возникают молниеносные движения в мышцах: от лёгкого подёргивания кончиков пальцев до патологического вздрагивания всего тела, которое может привести к падению.
Чаще всего подёргивания возникают в верхнем плечевом поясе: мышцах рук и плеч с обоих сторон. Из-за этого пациенты нередко выпускают предметы из рук, например разбивают кружки и роняют зубные щётки. Однако возможны различные вариации миоклоний.
Приступы учащаются в утренние часы, особенно при недосыпе или вынужденном пробуждении.
В 90 % случаев, помимо миоклонических эпизодов, отмечаются и генерализованные судорожные приступы [6] . После серии вздрагиваний в патологический процесс часто вовлекаются обе стороны тела.
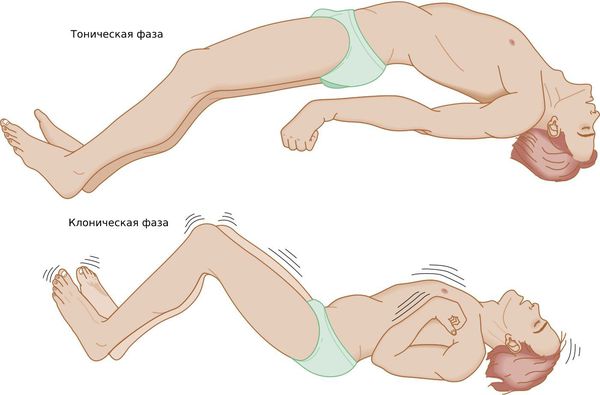
Генерализованный тонико-клонический приступ — состояние, при котором полностью отключается сознание. Приступ начинается с тонической фазы: напряжения в мышцах и специфического вскрикивания или хрипения. Руки полусогнуты и приподняты вверх или прижаты к телу. В этот момент из-за спазма дыхательной мускулатуры меняется цвет лица: оно синеет или сереет.
Далее развивается клоническая фаза, которая проявляется ритмичными подёргиваниями в конечностях. Она завершается полным мышечным расслаблением.
Третий вид эпилептических приступов при юношеской миоклонической эпилепсии — это абсансы [8] . Во время эпизода больной застывает, его взгляд устремлён в одну точку, сознание отключено. Состояние длится до 15 секунд и часто воспринимается окружающими как задумчивость. Сами пациенты могут не замечать эти приступы или воспринимать их как "провалы в памяти".
Патогенез юношеской миоклонической эпилепсии
Мозг человека состоит из двух основных типов клеток: нейронов и глии. Нейроны — это электрически возбудимые клетки, которые обрабатывают, хранят и передают информацию с помощью электрических и химических сигналов. Глиальные клетки играют в этом процессе вспомогательную роль.
Нейроны могут соединяться друг с другом и образовывать нервные сети. В пределах одного нейрона и его отростков информация передаётся в виде электрического возбуждения. В синапсе (месте контакта между нервными клетками) оно приводит к выделению различных химических веществ — нейромедиаторов.
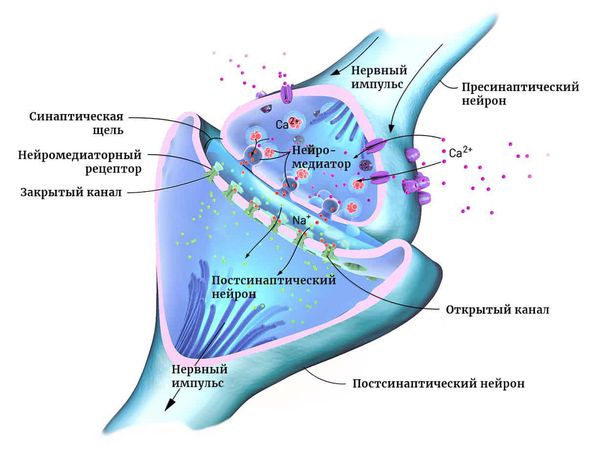
Нейромедиатор взаимодействует с рецепторами на мембране следующего нейрона. В результате в нём возникает электрическое возбуждение. Или не возникает — это зависит от конкретного нейромедиатора, активного в данный момент.
Чтобы заряд менялся в сторону возбуждения, в клетку должны поступать положительно и отрицательно заряженные ионы. Они проходят через ионные каналы в её мембране. Ионными каналами называют белки, образующие п о́ ру для обмена клетки с окружающей средой ионами K+, Na+ и другими [9] .
В нервных сетях между возбуждением и торможением работы нейронов поддерживается постоянный баланс. При сдвиге равновесия в сторону возбуждения происходит эпилептический приступ.
К юношеской миоклонической эпилепсии приводят мутации в генах ионных каналов. Однако выявлены нарушения и в других генах, также влияющих на процессы возбуждения в головном мозге [4] .
Классификация и стадии развития юношеской миоклонической эпилепсии
В Международной классификации болезней (МКБ-10) юношеская миоклоническая эпилепсия шифруется кодом G40.3 [10] .
В 2017 году Международная лига борьбы с эпилепсией (ILAE) обновила классификацию заболевания, выделив четыре уровня диагностики:
1. Определить тип приступа: фокальный (возникающий из одного очага), генерализованный и с неизвестным началом. Миоклонические, тонико-клонические приступы и абсансы относятся к генерализованным приступам.
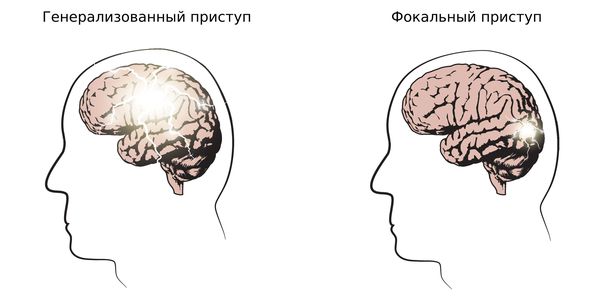
2. Установить тип эпилепсии: фокальная, генерализованная, сочетанная (фокальная + генерализованная) и неизвестная. Юношеская миоклоническая эпилепсия относится к генерализованной эпилепсии.
3. Определить эпилептический синдром. Юношеская миоклоническая эпилепсия как раз и является синдромом. Синдром включает типы приступов, возраст дебюта заболевания, характерные изменения на ЭЭГ, провоцирующие факторы и зачастую прогноз заболевания. Все эти факторы определяют лечебную тактику [11] .
4. Выявить причины заболевания: генетические, структурные, метаболические, иммунные, инфекционные и с неизвестной этиологией. Юношеская миоклоническая эпилепсия в большинстве случаев вызвана генетическими факторами.
Классификация юношеской миоклонической эпилепсии проводится в зависимости от течения заболевания. Главный критерий — это наличие миоклонических приступов. Также выделяют варианты течения с добавлением генерализованных судорожных приступов и/или абсансов.
Осложнения юношеской миоклонической эпилепсии
Пациенты часто не обращают внимания на патологические сокращения мышц, поэтому к неврологу и эпилептологу больной зачастую обращается после появления генерализованных тонико-клонических приступов. В результате противоэпилептические препараты назначают с опозданием. На фоне этого приступы могут учащаться и угрожать здоровью и жизни пациента травмами и утоплениями.
Серьёзным осложнением эпилепсии, в том числе и юношеской миоклонической эпилепсии, является внезапная смерть (SUDEP — Sudden Unexpected Death EPilepsy). Среди людей, страдающих эпилепсией, риск внезапной смерти в 20 раз выше, чем среди населения в целом [12] .
Точные причины SUDEP не установлены. Предполагается, что гибель пациентов связана с нарушением дыхания и развитием аритмии после приступа. Вероятность внезапной смерти при эпилепсии повышается при наличии генерализованных тонико-клонических приступов. Также важно, когда заболевание проявилось и сколько оно длится [12] .
При наличии дневных генерализованных приступов в течение предыдущего года риск развития SUDEP возрастает в 27 раз, ночных — в 15 раз. Проживание в одиночестве повышает риск внезапной смерти в 5 раз. Также SUDEP чаще встречается при злоупотреблении психоактивными веществами и алкоголем [13] .
Снизить риск внезапной смерти при эпилепсии можно, если придерживаться назначенного лечения: не пропускать приём противоэпилептических препаратов, не менять самостоятельно его частоту и дозировку [14] [15] .
Диагностика юношеской миоклонической эпилепсии
Основной диагностический критерий заболевания — это наличие миоклонических приступов.
Сбор анамнеза
На приёме врач спрашивает о необычных внезапных состояниях:
- вздрагиваниях в теле;
- дежавю — состоянии, при котором человек ощущает, что когда-то уже был в подобной ситуации или месте;
- потере сознания и т. д.
Пациенты могут не обращать внимания на такие симптомы и считать их своей особенностью. Абсансы и генерализованные тонико-клонические приступы с потерей сознания, особенно во сне, они могут и вовсе забывать. Поэтому при сборе анамнеза важно выяснить обстоятельства приступа не только у самих пациентов, но и у родственников и очевидцев.
Электроэнцефалограмма (ЭЭГ)
Основным способом диагностики эпилепсии является электроэнцефалограмма — метод исследования, при котором регистрируется суммарная электрическая активность клеток коры головного мозга.
Сейчас диагноз "эпилепсия" устанавливают с помощью длительного видео-ЭЭГ мониторинга — электроэнцефалограмма записывается параллельно с одной или несколькими видеокамерами, датчиком ЭКГ и при необходимости дополнительным контролем мышечной активности, частоты и глубины дыхания.
Основной фон биоэлектрической активности при юношеской миоклонической эпилепсии, как правило, соответствует возрастной норме. Патологическая активность проявляется короткими и генерализованными разрядами полиспайков (островолновых комплексов), которые регистрируются при миоклонических вздрагиваниях и полипик-волновыми комплексами между приступами.
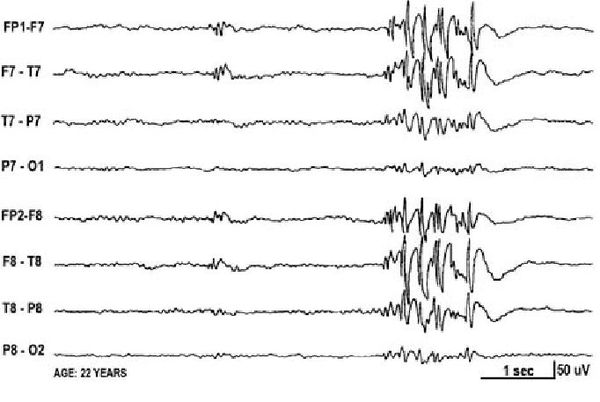
При заболевании часто встречается феномен фотосенситивности. Для её выявления во время ЭЭГ пациента просят закрыть глаза и проводят ритмичную фотостимуляцию с частотой около 15 Гц [16] .
Эпилептическая фотосенситивность — это предрасположенность к приступам под влиянием света. Может протекать бессимптомно или проявляться эпилептическими приступами под воздействием провоцирующих факторов: видеоигр, работы за компьютером, просмотра телевизора, мигающего освещения в ночных клубах и света природного происхождения.
На МРТ патологические изменения в головном мозге при юношеской миоклонической эпилепсии не выявляются [17] .
Интеллект и неврологический статус при заболевании находятся в норме. Выражена эмоциональная неустойчивость и признаки невротического развития личности: резкая смена настроения, вспыльчивость и повышенная тревожность
Лечение юношеской миоклонической эпилепсии
Образ жизни
При эпилепсии следует соблюдать режим сна и бодрствования, исключить алкоголь и избегать резких вспышек света. Также нужно по возможности уменьшить стрессы, переживания и тревоги [20] .
Антиэпилептические препараты
Приём антиэпилептических препаратов (АЭП) позволяет устранить до 90 % приступов. Монотерапия (лечение одним препаратом) при юношеской миоклонической эпилепсии применяется в 79 % случаев, дуотерапия (двумя препаратами) — 17 %, политерапия (несколькими препаратами) — 4 % [16] .
Прекращать приём лекарств рекомендуется не ранее чем через пять лет полной клинико-нейрофизиологической ремиссии. Но даже спустя 4–7 лет ремиссии рецидивы после отмены терапии возникают у 70 % больных. Поэтому пациентам с юношеской миоклонической эпилепсией может быть рекомендован пожизненный приём АЭП [21] .

Ранее лидерами в лечении юношеской миоклонической эпилепсии являлись препараты вальпроевой кислоты. Они эффективны для прекращения приступов, но вызывают много побочных эффектов:
Также выявлено, что они обладают повышенным тератогенным эффектом по сравнению с другими АЭП. Тератогенное действие — это нарушение эмбрионального развития ребёнка при приёме препаратов матерью. Поэтому назначение вальпроатов, в особенности у молодых женщин, ограничено [18] .
В настоящее время препаратом выбора стартовой терапии является "Леветирацетам". Он хорошо переносится и эффективно устраняет все три вида приступов, в том числе сопровождающихся фотосенситивностью [19] .
Также используется препарат "Ламотриджин". Он эффективно подавляет генерализованные тонико-клонические судороги и абсансы, но в половине случаев способствует учащению миоклоний. Его применение в монотерапии у пациентов с частыми миоклоническими приступами ограничено, но лекарство можно использовать в комбинированной терапии [21] .
Помимо перечисленных препаратов, могут применяться "Топирамат", "Зонисамид", "Перампанел" и "Фенобарбитал".
Чтобы избежать учащения приступов и усиления симптомов, важно ограничить приём "Карбамазепина", "Окскарбазепина", "Фенитоина", "Габапентина" и "Вигабатрина". Эти лекарства могут повышать гипервозбудимость мембраны клеток головного мозга, что приводит к обострению состояния [21] .
Прогноз. Профилактика
Прогноз определяется индивидуально в зависимости от частоты приступов, эффективности АЭП, возраста начала заболевания и т. д. Лечение часто не помогает пациентами с тремя видами приступов [21] .
Без приёма противоэпилептических препаратов (АЭП) приступы могут сохраняться всю жизнь. Их частота, как правило, снижается только после 40 лет [20] .
Эффективность АЭП в предотвращении приступов достигает 90 %. При отмене терапии часто возникают рецидивы, поэтому потребуется длительный приём препаратов, иногда пожизненный.
Качество жизни значительно ухудшается при частых миоклонических и генерализованных тонико-клонических приступах, при которых пациенты рискуют получить травмы.
Профилактика
Особое внимание стоит уделить образу и режиму жизни пациента. Самыми мощными провоцирующими факторами являются недосыпание и злоупотребление алкоголем. А учитывая, что дебют заболевания приходится на подростковый возраст, молодые люди часто нарушают эти рекомендации, особенно в студенческие годы.
Пациент, у которого выявили фотосенситивность, предрасположен к приступам под воздействием мерцающего света. Поэтому им необходимо ограничить просмотр телевизора и работу за компьютером, исключить видеоигры и избегать посещения ночных клубов.
У всех пациентов с эпилепсией имеются определённые социальные ограничения: они не могут работать в некоторых сферах, водить автомобиль и нести военную службу. Все они определяются индивидуально соответствующими комиссиями.
А.М. Пивоварова, канд. мед. наук, Е.И. Шабельникова, канд. мед. наук, З.К. Горчханова, канд. мед. наук, ОСП «Научно-исследовательский клинический институт педиатрии» ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России, г. Москва
Ключевые слова: фебрильные судороги, эпилептические приступы, эпилепсия, лихорадка
Keywords: febrile seizures, epileptic seizures, epilepsy, fever
Резюме. В статье даны ответы на основные вопросы о фебрильных судорогах: насколько часто они возникают, какие факторы предрасполагают к их развитию, высок ли риск их трансформации в эпилепсию и от чего зависит его уровень, какие меры следует предпринять родителям при возникновении фебрильных судорог, каков прогноз и риск рецидива, насколько необходимо лечение при этом состоянии и т. д.
Summary. The article provides answers to the main questions about febrile seizures: how often they occur, what factors predispose to their development, whether the risk of their transformation into epilepsy is high and what its level depends on, what measures should be taken by parents in the event of febrile seizures, what is the prognosis and the risk of relapse, how necessary is treatment for this condition, etc.
Еще в 400 г. до н. э. Гиппократ описывал фебрильные судороги, возникающие у детей с острой лихорадкой. Он заметил, что они характерны для очень маленьких детей, как правило не старше 7 лет, и что дети в более старшем возрасте, а также взрослые не склонны к таким судорогам.
Что такое фебрильные судороги и при каких условиях они возникают?
Фебрильные судороги – это состояние, которое зависит от возраста и возникает преимущественно при генетической предрасположенности к судорожным приступам, провоцируемым лихорадкой.
Согласно международной классификации, фебрильные судороги не являются эпилепсией.
Данное состояние провоцируется высокой температурой тела (не менее 38°С при ректальном измерении). Обычно приступы дебютируют в возрасте от 6 мес до 6 лет и являются эпилептическими по патогенетическому механизму.
Какова распространенность фебрильных судорог?
Какова этиология фебрильных судорог?
Основными причинами развития фебрильных судорог считаются лихорадка, виремия, генетические нарушения, перинатальная патология центральной нервной системы.
Частота фебрильных судорог у родственников пробандов: у родителей – 12%, у сибсов – 25%. Если оба родителя страдали фебрильными судорогами, то риск их развития у ребенка составляет 55%, при наличии фебрильных судорог у одного из родителей – 20%.
Определены локусы, отвечающие за предрасположенность к фебрильным судорогам: 8q13-q21 (FEB1), 19p (FEB2), 2q23-q24 (FEB3), 5q14-q15 (FEB4), 6q22-q24 (FEB5), 18p11 (FEB6).
Предположительный тип наследования – аутосомно-доминантный с неполной пенетрантностью гена, возможно также полигенное наследование [1,2].
Фебрильные судороги, как правило, развиваются на фоне вирусных и бактериальных инфекций, инфекции верхних дыхательных путей (38%), отитов среднего уха (23%), пневмонии (15%), гастроэнтерита (7%), герпетической инфекции 6-го типа (детской розеолы) (5%).
Чаще всего судороги возникают при температуре тела от 38 до 40°С, и степень тяжести приступа не зависит от температуры. Быстрое повышение температуры не увеличивает риск развития судорог, и при наличии семейного отягощенного анамнеза судороги могут возникнуть и при невысокой температуре. Чаще всего (57%) фебрильные приступы развиваются в первые 24 ч от начала лихорадки и только в 22% случаев – более чем через 24 ч.
Какие типы фебрильных судорог выделяются?
Принято различать следующие клинические варианты фебрильных судорог:
- простые фебрильные судороги (составляют 8090% всех случаев);
- сложные фебрильные судороги;
- фебрильный эпилептический статус.
Сложные фебрильные судороги характеризуются повторениями в течение 24 ч, большей продолжительностью (>15 мин) и носят генерализованный и/или фокальный характер (парциальные моторные приступы, девиация глазных яблок в сторону, аура). Наблюдается постприступная неврологическая симптоматика (возможны парезы конечностей – паралич Тодда).
Фебрильный статус развивается приблизительно в 4% случаев и состоит из приступа или серии приступов продолжительностью >30 мин, в межприступном периоде отсутствует сознание. Фебрильный статус не имеет летального исхода. Такие приступы чаще встречаются у девочек с генетической отягощенностью по фебрильным судорогам.
Связано ли развитие фебрильных судорог с отягощенным перинатальным анамнезом и какова вероятность развития эпилепсии у детей с фебрильными судорогами?
Однако есть и другие данные. M. Vestergaard и соавт. при длительном проспективном наблюдении 49 857 детей с фебрильными судорогами, родившихся с 1978 по 2002 г., установили, что риск развития эпилепсии у них составил 5,43%, причем он был выше у тех детей, у которых фебрильные судороги дебютировали до 1 года или после 3 лет.
Авторы также проанализировали основные перинатальные факторы риска возникновения фебрильных судорог. По сравнению с контрольной группой в группе детей с фебрильными судорогами была выше частота следующих факторов:
- в 5 раз – выкидышей у матерей;
- в 3 раза – нефропатии у матерей;
- в 9,8 раза – реанимации новорожденных;
- в 4 раза – сепсиса новорожденных [6].
В целом риск трансформации фебрильных судорог в эпилепсию составляет 2% (в популяции – 0,5%), причем он варьирует в зависимости от типа приступа: после простого фебрильного приступа – 1,5%, после многократных фебрильных приступов – 4%. При наследственной отягощенности по эпилепсии риск достигает 4%, при наличии неврологического дефицита – 30%, после фокального фебрильного приступа – 29%, после фокального приступа при наличии изменений неврологического статуса – 17%, после пролонгированного приступа – 6%, после повторяющихся фокальных приступов большой продолжительности – 50%.
Таким образом, основными факторами риска трансформации фебрильных судорог в эпилепсию являются:
- наследственная отягощенность по эпилепсии;
- фокальный характер приступов;
- продолжительность приступа >15 мин;
- повторные и множественные (>3) приступы фебрильных судорог;
- наличие неврологической патологии.
Какие основные эпилептические синдромы могут начинаться с фебрильных судорог?
Чаще всего фебрильные судороги трансформируются в генерализованные формы эпилепсии, реже в парциальные (височные). Существуют отдельные эпилептические синдромы типа «+ фебрильные судороги». В анамнезе 15% детей с впервые диагностированной эпилепсией имеются фебрильные судороги.
Синдромы, в дебюте которых наиболее часто возникают фебрильные судороги:
- идиопатические фокальные эпилепсии (у 10-45% больных в анамнезе);
- идиопатические генерализованные эпилепсии (чаще при детской абсансной эпилепсии – 15-20%, при доброкачественной миоклонической эпилепсии младенчества – 27%);
- идиопатическая эпилепсия с фокальными судорогами;
- тяжелая миоклоническая эпилепсия младенчества (синдром Драве);
- симптоматическая палеокортикальная височная эпилепсия;
- синдром HHE (hemiconvulsion-hemiplegia epilepsy syndrome, синдром гемиконвульсивных приступов, гемиплегии и эпилепсии);
- синдром DESC (devastating epileptic encephalopathy in school-aged children, разрушительная эпилептическая энцефалопатия у детей школьного возраста);
- синдром Ангельмана [7, 8].
В 2006 г. группой французских неврологов под руководством O. Dulac впервые был описан синдром DESC, развивающийся в 4-11 лет у неврологически абсолютно здоровых детей. На фоне гипертермии развиваются эпилептические приступы, частота которых быстро нарастает, и клонико-тонические приступы переходят в эпилептический статус, который характеризуется высокой продолжительностью (от нескольких недель до нескольких месяцев). В это время ребенок находится в сопоре. В дальнейшем развиваются афебрильные приступы с трансформацией в тяжелую фокальную эпилепсию (обычно в височную).
Следующий синдром был описан группой H. Gastaut в 1957 г. синдром HHE дебютирует в возрасте от 4 мес до 4 лет (чаще до 2 лет). Для него характерен фебрильный статуc – гемиконвульсивный эпилептический приступ, купирующийся в реанимационном отделении, после чего развивается гемипарез.
Повторные латерализованные фебрильные судороги вызывают склероз гиппокампа, который, в свою очередь, приводит к развитию медиальной височной эпилепсии. Порок развития гиппокампа является причиной и фебрильных судорог, и эпилепсии [9].
Возможно ли развитие эпилепсии после длительных фебрильных судорог?
В настоящее время считается, что развития длительных фебрильных судорог недостаточно для формирования эпилепсии, но, возможно, они снижают порог судорожной готовности. P.R. Camfield и соавт. сообщили, что частота фебрильного статуса с последующим развитием резистентной височной эпилепсии составляет 1 случай на 150 тыс. детей [10].
Возникают ли нарушения нервно-психического развития после фебрильных судорог?
Каков риск повторения фебрильных судорог?
Риск развития рецидива фебрильных судорог в среднем составляет от 30 до 40%. Если был повторный приступ, то рецидив возможен в 50% случаев. Только в 10% случаев у пациентов развиваются 3 и более фебрильных приступа, и, как правило, рецидив возникает в течение 1 года после приступа.
Основными факторами, увеличивающими риск повторных фебрильных судорог, являются:
Таким образом, возможно приблизительно рассчитать риск развития повторных фебрильных судорог:
- при отсутствии факторов риска – 10%;
- при наличии 1 или 2 факторов риска – 30-50%;
- при наличии 3 и более факторов риска – 50-100%;
- при профилактике диазепамом и наличии факторов риска – 12% [11].
Какие исследования необходимо назначить ребенку с развившимися фебрильными судорогами?
Детям с фебрильными судорогами в анамнезе не показаны:
- электроэнцефалография;
- магнитно-резонансная томография.
Клиницисты, осматривающие младенцев или маленьких детей после простого фебрильного приступа, должны обратить особое внимание на выявление причины лихорадки у ребенка. Если судороги длятся более 15 мин, развиваются фокальные моторные и немоторные приступы с нарушением сознания и при этом присутствуют такие клинические признаки, как сонливость, чередующаяся с раздражительностью, или оглушение (
Необходима ли госпитализация?
Не рекомендовано госпитализировать клинически стабильных детей старше 18 мес без симптомов, требующих диагностических исследований [12].
Какие рекомендации врач должен дать родителям ребенка с фебрильными судорогами на амбулаторном приеме?
В первую очередь необходимо объяснить родителям правила поведения при судорожном приступе:
- не паниковать;
- расстегнуть ребенку воротник, освободить от тесной одежды;
- положить ребенка на спину на кровать и повернуть голову ребенка на бок;
- изолировать от повреждающих предметов, не пытаться разжать челюсти;
- наблюдать за течением приступа (зафиксировать его продолжительность);
- при рвоте удерживать ребенка на боку;
- не давать никаких лекарств и жидкостей перорально;
- находиться возле ребенка до полного прекращения приступа;
- измерить температуру;
- не тревожить ребенка после приступа, дать ему выспаться.
Необходим вызов бригады скорой помощи или немедленная консультация врача в следующих случаях:
- приступ продолжается больше 10 мин;
- развиваются повторные приступы;
- судороги развились у ребенка младше 6 мес;
- наличествует неврологическая симптоматика.
Нужно ли лечить фебрильные судороги?
В первую очередь необходимо понимать, что фебрильные судороги не способствуют формированию неврологических нарушений, риск трансформации фебрильных судорог в эпилепсию невелик. К сожалению, профилактическое лечение не снижает риск трансформации фебрильных судорог в эпилепсию. И особенно важно учесть риск возникновения побочных эффектов антиконвульсантной терапии [11].
Если развился простой фебрильный приступ, то ребенка лечить не нужно. Антипиретики улучшают самочувствие ребенка, но не влияют на тяжесть приступа.
При развитии сложного приступа или фебрильного статуса необходимо купирование самого приступа. В этом случае предпочтение отдается бензодиазепинам (ректальному либо внутривенному введению диазепама).
Для профилактики рецидивов назначается интермиттирующая антиконвульсантная профилактика (на период сохранения лихорадки), также возможна длительная антиконвульсантная профилактика.
Для интермиттирующей профилактики применяют бензодиазепины (диазепам) перорально в дозах 0,3; 0,5; 0,8 мг на кг массы тела в сутки в 3 приема. Курс длится с момента появления первых признаков заболевания до 2-го дня без лихорадки. Назначают также клобазам перорально в дозе, зависящей от веса ребенка: 15 кг – по 10 мг 2 раза в день [12, 13]. Возможен прием фенобарбитала в обычных терапевтических дозах.
Длительная профилактика фебрильных судорог нецелесообразна. Нет никаких доказательств того, что непрерывный или интермиттирующий прием противоэпилептических препаратов при фебрильных судорогах может предотвратить последующее развитие эпилепсии [12].
Являются ли фебрильные судороги противопоказанием к плановой вакцинации?
Фебрильные судороги в анамнезе не являются поводом для отмены плановой вакцинации. Но существуют некоторые ограничения:
- прививка против полиомиелита (живой вакциной) – не ранее чем через 1 мес после приступа фебрильных судорог;
- вакцинация против кори – не ранее чем через 6 мес после приступа;
- рекомендована постоянная замена АКДС на АДСм [12].
Каков прогноз?
Прогноз благоприятный: фебрильные судороги самостоятельно прекращаются в возрасте 5-6 лет.
Фебрильные судороги являются объектом пристального внимания педиатров и неврологов, так как могут служить причиной развития у детей эпилепсии, стойкого интеллектуального и неврологического дефицита [1].
ФЕБРИЛЬНЫЕ СУДОРОГИ (ФС) – самое частое неврологическое нарушение в детском возрасте. Из самого термина следует, что повышение температуры тела имеет непосредственное отношение к ФС. Механизмы термогенеза при ФС многочисленны и неоднозначны [2].
Фебрильные судороги — пароксизмы различной продолжительности, протекающие преимущественно в виде тонических или тонико-клонических припадков в конечностях и возникающие у детей грудного, раннего и дошкольного возраста при температуре тела не менее 37,8—38,5°С (исключая судороги при нейроинфекциях), с возможностью трансформации в афебрильные судороги и эпилепсию.
Диагноз «фебрильные судороги» правомочен в возрасте от 6 месяцев до 6 лет [4, 5]. M.I. Lorin (1982) указывал, что у 2–4% детей в возрасте от 6 месяцев до 5 лет отмечается хотя бы один эпизод ФС [6]. 93% первых ФС приходятся на возраст от 6 месяцев до 3 лет [1]. В настоящее время в США и Европе распространенность ФС составляет 2–4% [1].
Причины
Любое инфекционное заболевание может провоцировать ФС. До трети случаев ФС у детей первого года жизни проявляются на фоне инфекций, вызванных вирусом герпеса 6-го типа; другие вирусы сравнительно редко провоцируют ФС. Значительная роль в провокации ФС принадлежит бактериальному поражению дыхательных путей и острому гастроэнтериту [1, 5].
Неинфекционные причины возникновения ФС:
- прорезывание зубов,
- гипертермии эндокринного, резорбтивного, психогенного, рефлекторного и центрального генезов [1, 4, 5, 6].
Роль нарушений метаболизма некоторых макро- и микроэлементов (Са и др.) в развитии ФС может быть весьма значительной [7].
Многочисленными наблюдениями подтверждается генетическая предрасположенность к ФС. A.T. Berg (1992) указывает, что у 24% детей с ФС члены семьи страдали аналогичной патологией. Лишь у 20% пациентов в семейном анамнезе отсутствуют указания на ФС [8]. Тип наследования ФС окончательно не установлен, но предполагается аутосомно-доминантная или полигенная передача [1, 9]. Картированы не менее четырех аутосомно-доминантных генов, ответственных за ФС (19р13.3, 19q, 8q13-q21, 2q23-34).
Клиника
Чаще приступ ФС протекает по типу генерализованного эпилептического приступа (симметричные тонико-клонические судороги в конечностях), но симптомы указанного состояния не всегда столь однозначны [10].
Выделяют типичные и атипичные ФС. Первые имеют небольшую продолжительность (до 15 минут), генерализованный характер; показатели психомоторного развития обычно соответствуют возрастным, нет типичных изменений на ЭЭГ. При атипичных ФС продолжительность приступа составляет более 15 минут (до нескольких часов), имеется генерализация (возможен фокальный компонент) и латерализация; иногда – постиктальная гемиплегия (в 0,4% случаев), на ЭЭГ нередки фокальные изменения [4].
При типичных ФС характерно отсутствие в анамнезе указаний на органическое поражение ЦНС, а при атипичных ФС велика частота перинатального поражения ЦНС и черепно-мозговых травм.
В 96,9% случаев отмечаются простые ФС, а у 3,1% пациентов – сложные [10, 11]. Простые и сложные судороги – не эквиваленты типичных и атипичных ФС. S. Livingston (1972) причисляет к сложным ФС приступы продолжительностью более 30 минут, с рецидивом в течение 24 часов и очаговыми симптомами [11].
Диагностика
Диагноз ФС устанавливается на основании анамнеза, оценки соматического и неврологического статусов, психомоторного и эмоционального развития, особенностей течения приступа (продолжительность, локализация, генерализация, латерализация, наличие постприступной гемиплегии и т.д.) [1, 4, 10].
Диагностическая ценность лабораторно-инструментальных методов при ФС ограничена. Целесообразность использования КТ или МРТ после первого приступа ФС дискутабельна [11]. ЭЭГ-исследование (через 7–20 дней после приступа; в большинстве стран входит в протокол обследования) выявляет специфические изменения у 1,4–22% детей с ФС [1, 10, 11, 12]. Люмбальная пункция довольно инвазивна, хотя предусмотрена для исключения нейроинфекций у детей с судорогами на фоне фебрильной температуры [1]. Тест пароксизмальной активности позволяет определять уровень аутоантител к глутаматным АМРА-рецепторам, относя имеющиеся пароксизмы к эпилептическим или неэпилептическим (по степени деструкции нейронов) [13]. Результаты биохимического исследования крови позволяют обнаружить различные метаболические нарушения (Са, Mg и др.), поэтому они важны при проведении дифференциальной диагностики ФС с другими состояниями [1, 7].
Дифференциальный диагноз
Истинные ФС дифференцируют от других судорог, возникающих при повышении температуры:
- эпилептические припадки, вызванные лихорадкой;
- судороги при нейроинфекциях (менингит, энцефалит);
- метаболические судороги (гипогликемия, гипокальциемия и т.д.) – при инфекционных заболеваниях и без таковых [1, 10].
Судороги у детей в возрасте до 6 лет на фоне повышенной температуры бывают обусловлены нейроинфекциями, не являясь истинными ФС. Л.О. Бадалян (1990) указывал, что даже один афебрильный пароксизм свидетельствует о течении эпилепсии [4]. Это положение не столь однозначно, так как афебрильные пароксизмы могут вызываться интоксикациями, быть следствием аффективно-респираторных нарушений и т.д.
Лечение приступов ФС
Для коррекции приступов ФС используют диазепам (Седуксен), лоразепам (Лорафен) или фенобарбитал [14]. Диазепам назначают в дозе 0,2–0,5 мг/кг/сут, лоразепам – 0,005–0,02 мг/кг/сут, фенобарбитал – 3–5 мг/кг/cут [14, 15, 16]. Для снижения температуры тела рекомендуются физические методы охлаждения: обтирание тела водой (прохладной или теплой) или спиртовыми растворами, раздевание ребенка, проветривание помещения и т.д.
При ФС показано назначение антипиретиков – ибупрофена и парацетамола [10]. Ибупрофен назначают по 5–10 мг/кг (разовая доза) не чаще 4 раз в сутки. Парацетамол применяют в дозе 10–15 мг/кг/сут (ректально – до 20 мг/кг/сут). Может использоваться напроксен (5 мг/кг – 2 раза в сутки) [10, 15]. При ФС начинают снижать повышенную температуру тела, даже когда ее уровень не достиг фебрильных цифр.
Превентивное лечение
Основным вопросом остается целесообразность специфического лечения (межприступного) ФС. В первые два дня лихорадки детям, у которых ранее отмечались ФС, с профилактической целью назначают диазепам – по 0,3–0,4 мг/кг через каждые 8 часов; в качестве альтернативы используется клобазам (0,5 мг/кг/сут, в 1–2 приема). Эффективность обоих препаратов не доказана [10].
Ранее сообщалось, что для профилактики ФС эффективны вальпроаты, карбамазепин, фенобарбитал и фенитоин [4]. Их эффективность маловероятна и не доказана [1, 10]. В нашей стране детские неврологи для профилактики повторных приступов ФС нередко используют противосудорожные свойства ацетазоламида (Диакарб).
Три варианта превентивного лечения ФС:
- длительный прием антиэпилептических препаратов (2–5 лет);
- интермиттирующий прием антиэпилептических препаратов;
- отказ от медикаментозной профилактики (кроме жаропонижающих средств) [10, 14].
При первом эпизоде типичных (простых) ФС использование антиэпилептических препаратов не показано, а при атипичных ФС и/или повторных эпизодах иногда прибегают к постоянному или интермиттирующему применению антиэпилептических средств, предпочтение отдается карбамазепину и фенобарбиталу.
В настоящее время во всем мире склоняются к полному отказу от медикаментозной профилактики типичных ФС.
Вакцинация при ФС
При вакцинации на 1–2-м годах жизни вместо АКДС (цельноклеточная вакцина) используют АДС, но не АДС-м, так как последний препарат предназначен только для ревакцинации детей старше 6 лет [4, 17]. В России имеются бесклеточные вакцины против коклюша, дифтерии, столбняка зарубежного производства, которые можно применять при иммунизации детей первых лет жизни вместо АДС [18]. Иммунопрофилактика гепатита В проводится в полном объеме, а вопрос о вакцинации детей против кори, краснухи и эпидемического паротита решается индивидуально (контроль данных ЭЭГ, учет давности последнего эпизода ФС и т.д.).
Прогноз
Значение придается трем прогностическим аспектам ФС: вероятность повтора приступа, трансформации в эпилепсию, формирование стойкого неврологического и интеллектуального дефицита [1]. Исходы ФС варьируют от полного выздоровления до трансформации в афебрильную форму пароксизмов или эпилепсию, и даже до летального исхода [1, 4, 8, 9]. Вероятность трансформации ФС в эпилепсию при наличии «сложного» приступа в 3 раза выше, чем при первом, «простом». Вообще трансформация ФС в эпилепсию имеет место в 4–12% случаев [1, 4, 8]. Интеллектуальное развитие детей с ФС соотносится с общим числом перенесенных пароксизмов [19]. Нарушения в этой сфере больше присущи пациентам с атипичными ФС [4].
Открытым вопросом остается установление ФС у детей в возрасте до 6 месяцев, хотя относительная редкость термических реакций у детей первых месяцев жизни (несовершенство термогенеза) и вероятность задействования «нефебрильных» факторов (метаболических и др.) не отвергают возможности развития ФС у детей первого полугодия жизни. Разработка протоколов обследования, динамического наблюдения и профилактического лечения детей с ФС пока что остается задачей будущего [19].
Список использованной литературы находится в редакции.
Сведения об авторах:
Владимир Митрофанович Студеникин, главный научный сотрудник отделения психоневрологии НИИ педиатрии ГУ Научного центра здоровья детей РАМН, профессор, д-р мед. наук
Владимир Иванович Шелковский, врач отделения психоневрологии НИИ педиатрии ГУ Научного центра здоровья детей РАМН, заслуженный врач РФ, канд. мед. наук
Светлана Владимировна Балканская, старший научный сотрудник отделения психоневрологии НИИ педиатрии ГУ Научного центра здоровья детей РАМН, канд. мед. наук
Фебрильные судороги (ФС) – это конвульсивные приступы на фоне гипертермии, характерные для детей до 6 лет, у которых ранее ни разу не наблюдались судороги без повышенной температуры тела. Клиническими признаками являются потеря сознания, резкое напряжение скелетной мускулатуры, характерная поза, подергивание конечностей и бледность или цианоз кожи. Диагноз фебрильных судорог у детей основывается на анамнестических данных, уровне глюкозы в крови, анализе ликвора, показателях водно-электролитного баланса и инструментальных методах исследований центральной нервной системы – ЭЭГ, КТ, МРТ. Лечение подразумевает купирование приступов при помощи транквилизаторов или противоэпилептических средств и снятие гипертермии при помощи НПВС.
МКБ-10

Общие сведения
Фебрильные (температурные) судороги у детей – это неврологическое нарушение в педиатрии, которое характеризуется тоническими или тонико-клоническими припадками типического или атипического характера при температуре тела более 37,8°C. Впервые данное понятие ввел в 1954 году педиатр Ливингстон. Распространенность фебрильных судорог у детей от 6 месяцев до 6 лет составляет порядка 2-5%. Мальчики болеют чаще, чем девочки в соотношении 1,5-2:1. Пик заболеваемости наблюдается в возрасте 18 месяцев.
У 80% больных в семейном анамнезе присутствуют эпизоды судорожных припадков различной этиологии. У 25% детей родители также страдали от аналогичных проявлений в детском возрасте. В большинстве случаев исход заболевания благоприятный – после 6 лет фебрильные судороги у детей, как правило, не встречаются.

Причины
Фебрильные судороги у детей – гетерогенное патологическое состояние. Точная этиология и патогенез не установлены. Одним из возможных факторов развития патологии является незрелость ЦНС у детей до 6 лет, которая проявляется в склонности к генерализации процессов и слабости тормозной деятельности. На фоне данных особенностей и гипертермии могут возникать патологические импульсы, которые, вероятно, и являются причинами развития ФС.
Провоцирующие факторы
Потенциально спровоцировать развитие фебрильных судорог у детей могут все факторы, которые повышают температуру тела ребенка до 38°C и выше. К числу таких факторов относятся:
- вирусные инфекции (чаще всего – вызванные вирусом герпеса VI типа);
- бактериальные заболевания дыхательной системы и ЖКТ;
- реакции организма ребенка на прорезывание молочных зубов,
- эндокринные, психогенные и другие заболевания, протекающие на фоне гипертермии;
- нарушение водно-электролитного баланса (в первую очередь – Ca 2+ ).
Также прослеживается наследственная склонность к фебрильным судорогам у детей. Провоцировать их могут мутации в 19р13.3, 19q, 8q13-q21, 2q23-34. Тип наследования – аутосомно-доминантный. В редких случаях ФС развиваются в виде реакции на вакцины АКДС и КПК.
Симптомы фебрильных судорог
В большинстве случаев температурные судороги у детей возникают на протяжении первых 24 часов с момента повышения температуры тела ребенка выше 37,8°C. Приступ, как правило, протекает по типу генерализированного эпилептического припадка типического или атипического характера. Типический вариант ФС встречается намного чаще – примерно в 90% случаев. Он характеризуется длительностью до 15 минут, отсутствием очаговых симптомов и отклонений на ЭЭГ. Серия приступов длится не более 30 мин.
Одиночные атипические приступы фебрильных судорог у детей продолжаются более 15 минут, серии – от 30 мин. В своей структуре они могут содержать фокальные компоненты, которые проявляются как клинически, так и на ЭЭГ. Такой вариант характерен для детей с внутриутробными поражениями или родовыми травмами ЦНС.
Впервые фебрильные судороги детей проявляются в возрасте от 6 месяцев до 1,5 года. При развитии приступа сначала ребенок теряет сознание, далее наблюдается резкий спазм скелетной мускулатуры верхних и нижних конечностей, затем – всего тела. На фоне гипертонуса затылочных мышц возникает характерная поза с изгибом спины и запрокинутой назад головой. На этом этапе может отмечаться бледность кожных покровов, иногда – небольшой цианоз. Далее развиваются мышечные пароксизмы рук и ног. При окончании приступа симптомы исчезают в обратной последовательности. Некоторое время после припадка фебрильных судорог у детей сохраняется слабость, сонливость.
Диагностика
Диагностика фебрильных судорог у детей основывается на сборе анамнестических данных, физикальном обследовании, лабораторных и инструментальных тестах. При сборе анамнеза устанавливается возраст, в котором впервые возникли припадки, динамика развития заболевания, эпизоды подобных состояний у родственников. При осмотре детским неврологом или педиатром определяется неврологический статус и соматическое состояние ребенка, степень психофизического развития, во время припадка оценивается его длительность, наличие фокальных симптомов.
- Лабораторные исследования. Показатели общих лабораторных тестов крови и мочи в пределах нормы за исключением острой гипогликемии и гиперкальциемии. В большей степени анализы используются для проведения дифференциальной диагностики с другими патологиями. Для определения хромосомных мутаций, которые могут провоцировать развитие фебрильных судорог у детей, используется генетический анализ посредством кариотипирования.
- Люмбальная пункция. При подозрении на менингит или энцефалит показана спинномозговая пункция с микроскопическим и бактериологическим анализом полученного ликвора.
- Инструментальная диагностика. Из инструментальных методов исследования применяют электроэнцефалографию, реже – магнитно-резонансную и компьютерную томографии. По результатам ЭЭГ специфические изменения определяются менее чем у 22% детей. КТ и МРТ используются с целью исключения органической патологии ЦНС, внутричерепной гипертензии.
Дифференциальная диагностика фебрильных судорог у детей проводится с другими заболеваниями в педиатрии, которые также могут сопровождаться судорожными припадками. В число таких заболеваний входят нейроинфекционные патологии (менингит, энцефалит) эпилепсии различных форм, острые нарушения метаболизма и водно-электролитного баланса (гипогликемия, гиперкальциемия).
Лечение фебрильных судорог у детей
Во время приступа фебрильных судорог у детей применяется купирующая медикаментозная терапия. Она включает в себя транквилизаторы из группы бензодиазепинов с целью снятия судорожного синдрома, нестероидные противовоспалительные препараты для снижения температуры тела. Также осуществляется охлаждение ребенка физическими методами – обтирание теплой или прохладной водой, частое проветривание помещения, раздевание и др.
При атипичных формах ФС могут использоваться противоэпилептические средства – барбитураты или производные карбоксамида. В некоторых случаях при наличии фебрильных судорог у детей в анамнезе может назначаться превентивное лечение с использованием бензодиазепинов, вальпроатов, барбитуратов и некоторых диуретиков, обладающих противосудорожными свойствами – ингибиторов карбоангидразы.
Прогноз и профилактика
Прогноз для жизни при фебрильных судорогах у детей обычно благоприятный. Исходом может быть как полное выздоровление ребенка, так трансформация в эпилепсию. Прогноз оценивается с учетом вероятности повторных приступов в дальнейшем, перехода в эпилепсию, образования стойкого дефицита интеллекта или нарушения неврологического статуса. Практически всегда у детей старше 5-6 лет припадки полностью прекращаются. Возможные расстройства интеллекта зависят от частоты и характера приступов – при наличии частых и атипичных фебрильных судорог у детей существует более высокая вероятность нарушений психического развития (ЗПР, олигофрении). Трансформация в эпилепсию наблюдается у 5-15% пациентов, чаще – при наличии атипичных форм ФС.
Неспецифическая профилактика фебрильных судорог у детей в антенатальном периоде включает в себя медико-генетическое консультирование семейных пар, амнио- или кордоцентез с последующим генетическим анализом при отягощенном семейном анамнезе. Постнатальные превентивные меры подразумевают раннюю диагностику и полноценное лечение инфекционных заболеваний, метаболических нарушений и других провоцирующих состояний у пациентов, входящих в группу риска. С целью профилактики фебрильных судорог у детей во время вакцинации в возрасте 1-2 лет вместо вакцины АДКС используется АДС.
Судорожный синдром у детей – неспецифическая реакция организма ребенка на внешние и внутренние раздражители, характеризующаяся внезапными приступами непроизвольных мышечных сокращений. Судорожный синдром у детей протекает с развитием парциальных или генерализованных судорог клонического и тонического характера с потерей или без потери сознания. Для установления причин судорожного синдрома у детей необходимы консультации педиатра, невролога, травматолога; проведение ЭЭГ, НСГ, РЭГ, рентгенографии черепа, КТ головного мозга и пр. Купирование судорожного синдрома у детей требует введения антиконвульсантов и проведения терапии основного заболевания.
Общие сведения
Судорожный синдром у детей - частое ургентное состояние детского возраста, протекающее с развитием судорожных пароксизмов. Судорожный синдром встречается с частотой 17-20 случаев на 1000 детей: при этом 2/3 судорожных припадков у детей приходится на первые 3 года жизни. У детей дошкольного возраста судорожный синдром встречается в 5 раз чаще, чем в целом в популяции. Высокая распространенность судорожного синдрома в детском возрасте объясняется незрелостью нервной системы детей, склонностью к развитию общемозговых реакций и многообразием вызывающих судороги причин. Судорожный синдром у детей не может рассматриваться как основной диагноз, поскольку сопровождает течение большого круга заболеваний в педиатрии, детской неврологии, травматологии, эндокринологии.

Причины
Судорожный синдром у детей является полиэтиологическим клиническим синдромом. Неонатальные судороги, развивающиеся у новорожденных, обычно связаны с:
- тяжелым гипоксическим поражением ЦНС (гипоксией плода, асфиксией новорожденных);
- внутричерепной родовой травмой;
- внутриутробной или постнатальной инфекцией (цитомегалией, токсоплазмозом, краснухой, герпесом, врожденным сифилисом, листериозом и др.);
- врожденными аномалиями развития мозга (голопрозэнцефалией, гидроанэнцефалией, лиссэнцефалией, гидроцефалией и др.);
- алкогольным синдромом плода. Судороги могут являться проявлением синдрома абстиненции у детей, рожденных от матерей, страдающих алкогольной и наркотической зависимостью;
- редко у новорожденных возникают столбнячные судороги, обусловленные инфицированием пупочной ранки.
Среди метаболических нарушений, являющихся причиной судорожного синдрома, следует выделить следующие:
- электролитный дисбаланс (гипокальциемию, гипомагниемию, гипо- и гипернатриемию), встречающийся у недоношенных, детей с внутриутробной гипотрофией, галактоземией, фенилкетонурией.
- гипербилирубинемию и связанная с ней ядерная желтуха новорожденных.
- эндокринные нарушения - гипогликемию при сахарном диабете, гипокальциемию при спазмофилии и гипопаратиреозе.
В грудном и раннем детском возрасте в генезе судорожного синдрома у детей ведущую роль играют:
- нейроинфекции (энцефалиты, менингиты);
- инфекционные заболевания (ОРВИ, грипп, пневмония, отит, сепсис);
- ЧМТ;
- поствакцинальные осложнения;
- эпилепсия.
Менее частыми причинами судорожного синдрома у детей выступают опухоли мозга, абсцесс мозга, врожденные пороки сердца, отравления и интоксикации, наследственные дегенеративные заболевания ЦНС, факоматозы.
Определенная роль в возникновении судорожного синдрома у детей принадлежит генетической предрасположенности, а именно – наследованию особенностей метаболизма и нейродинамики, определяющих пониженный судорожный порог. Провоцировать судорожные припадки у ребенка могут инфекции, дегидратация, стрессовые ситуации, резкое возбуждение, перегревание и др.
Классификация
По происхождению различают эпилептический и неэпилептический (симптоматический, вторичный) судорожный синдром у детей. К числу симптоматических относятся фебрильные (инфекционные), гипоксические, метаболические, структурные (при органических поражениях ЦНС) судороги. Следует отметить, что в некоторых случаях неэпилептические судороги могут перейти в эпилептические (например, при длительном, более 30 минут некупируемом судорожном припадке, повторных судорогах).
В зависимости от клинических проявлений различают парциальные (локализованные, фокальные) судороги, охватывающие отдельные группы мышц, и генерализованные судороги (общий судорожный припадок). С учетом характера мышечных сокращений судороги могут быть клоническими и тоническими: в первом случае эпизоды сокращения и расслабления скелетных мышц быстро сменяют друг друга; во втором имеет место длительный спазм без периодов расслабления. В большинстве случаев судорожный синдром у детей протекает с генерализованными тонико-клоническими судорогами.
Симптомы
Типичному генерализованному тонико-клоническому припадку свойственно внезапное начало. Внезапно ребенок теряет контакт с внешней средой; его взгляд становится блуждающим, движения глазных яблок – плавающими, затем взор фиксируется вверх и в сторону.
В тоническую фазу судорожного приступа голова ребенка запрокидывается назад, челюсти смыкаются, ноги выпрямляются, руки сгибаются в локтевых суставах, все тело напрягается. Отмечается кратковременное апноэ, брадикардия, бледность и цианотичность кожных покровов. Клоническая фаза генерализованного судорожного припадка характеризуется восстановлением дыхания, отдельными подергиваниями мимической и скелетной мускулатуры, восстановлением сознания. Если судорожные пароксизмы следуют один за другим без восстановления сознания, такое состояние расценивают как судорожный статус.
Наиболее частой клинической формой судорожного синдрома у детей служат фебрильные судороги. Они типичны для детей в возрасте от 6 месяцев до 3-5 лет и развиваются на фоне подъема температуры тела выше 38 °С. Признаки токсико-инфекционного поражения головного мозга и его оболочек при этом отсутствуют. Длительность фебрильных судорог у детей обычно составляет 1-2 минуты (иногда до 5 минут). Течение данного варианта судорожного синдрома у детей благоприятное; стойких неврологических нарушений, как правило, не развивается.
Судорожный синдром у детей с внутричерепной травмой протекает с выбуханием родничков, срыгиваниями, рвотой, расстройствами дыхания, цианозом. Судороги при этом могут носить характер ритмичных сокращений определенных групп мышц лица или конечностей либо генерализованный тонический характер. При нейроинфекциях в структуре судорожного синдрома у детей обычно доминируют тонико-клонические судороги, отмечается ригидности затылочных мышц. Тетания, обусловленная гипокальциемией, характеризуется судорогами в мышцах-сгибателях («рука акушера»), лицевой мускулатуре («сардоническая улыбка»), пилороспазмом с тошнотой и рвотой, ларингоспазмом. При гипогликемии развитию судорог предшествует слабость, потливость, дрожь в конечностях, головная боль.
Для судорожного синдрома при эпилепсии у детей типична предваряющая приступ «аура» (ощущение озноба, жара, головокружения, запахов, звуков и пр.). Собственно эпилептический приступ начинается с крика ребенка, следующей за этим потерей сознания и судорогами. По окончании приступа наступает сон; после пробуждения ребенок заторможен, не помнит произошедшее.
В большинстве случаев установление этиологии судорожного синдрома у детей только на основании клинических признаков невозможно.
Диагностика
В силу многофакторности происхождения судорожного синдрома у детей, его диагностикой и лечением могут заниматься детские специалисты различного профиля: неонатологи, педиатры, детские неврологи, детские травматологи, детские офтальмологи, детские эндокринологи, реаниматологи, токсикологи и др.
Решающим моментом в правильной оценке причин судорожного синдрома у детей является тщательный сбор анамнеза: выяснение наследственной отягощенности и перинатального анамнеза, предшествующих приступу заболеваний, травм, профилактических прививок и пр. При этом важно уточнить характер судорожного припадка, обстоятельства его возникновения, продолжительность, повторяемость, выход из судорог.
Важное значение в диагностике судорожного синдрома у детей имеют инструментальные и лабораторные исследования. Проведение ЭЭГ помогает оценить изменения биоэлектрической активности и выявить судорожную готовность мозга. Реоэнцефалография позволяет судить о характере кровотока и кровоснабжения головного мозга. При рентгенографии черепа у ребенка может выявляться преждевременное закрытие швов и родничков, расхождение черепных швов, наличие пальцевых вдавлений, увеличение размеров черепа, изменения контуров турецкого седла, очаги обызвествления и другие признаки, косвенно свидетельствующие о причине судорожного синдрома.
Уточнить этиологию судорожного синдрома у детей в ряде случаев помогают нейросонография, диафаноскопия, КТ головного мозга, ангиография, офтальмоскопия, проведение люмбальной пункции. При развитии судорожного синдрома у детей необходимо выполнить биохимическое исследование крови и мочи на содержание кальция, натрия, фосфора, калия, глюкозы, пиридоксина, аминокислот.
Лечение судорожного синдрома у детей
При возникновении судорожного приступа ребенка необходимо уложить на твердую поверхность, повернуть голову набок, расстегнуть воротник, обеспечить приток свежего воздуха. Если судорожный синдром у ребенка развился впервые и его причины неясны, необходимо вызывать скорую помощь.
Для свободного дыхания следует удалить из полости рта слизь, остатки пищи или рвотных масс с помощью электроотсоса или механическим путем, наладить ингаляции кислорода. Если причина судорог установлена, то с целью их купирования проводится патогенетическая терапия (введение раствор кальция глюконата при гипокальциемии, раствора магния сульфата – при гипомагниемии, раствора глюкозы – при гипогликемии, антипиретиков – при фебрильных судорогах и т. д.).
Однако, поскольку в ургентной клинической ситуации не всегда удается осуществить диагностический поиск, для купирования судорожного пароксизма проводится симптоматическая терапия. В качестве средств первой помощи используют внутримышечное или внутривенное введение сульфата магния, диазепама, ГОМК, гексобарбитала. Некоторые противосудорожные препараты (диазепам, гексобарбитал и др.) могут вводиться детям ректально. Кроме противосудорожных препаратов, для профилактики отека головного мозга детям назначается дегидратационная терапия (маннитол, фуросемид).
Дети с судорожным синдромом неясного генеза, судорогами, возникшим на фоне инфекционных и метаболических заболеваний, травм головного мозга, подлежат обязательной госпитализации.
Прогноз и профилактика
Фебрильные судороги обычно прекращаются с возрастом. Для предупреждения их повторного возникновения не следует допускать выраженной гипертермии при возникновении у ребенка инфекционного заболевания. Риск трансформации фебрильных судорог в эпилептические составляет 2-10%.
В остальных случаях профилактика судорожного синдрома у детей включает предупреждение перинатальной патологии плода, терапию основного заболевания, наблюдение у детских специалистов. Если судорожный синдром у детей не исчезает после прекращения основной болезни, можно предположить, что у ребенка развилась эпилепсия.
Автор статьи

Читайте также:
- Судебная практика и ее роль в применении норм трудового законодательства
- Суд над саакашвили когда будет
- Уголовная политика это государственная программа борьбы с в действии
- Это право наций на самоопределение и создание различных форм национальной государственности
- Куда подавать иск о признании недействительной подписи

